气相毛细管色谱柱的五大进样方式(一)
来源:仪猫易拍 发布时间:2019-05-23 12:01
气相毛细管色谱柱有直接进样、分流进样、不分流进样、冷柱头进样和程序升温气化进样五种不同操作方式,各操作方式的原理和影响因素各不相同。
01
一大口径毛细管柱的直接进样
内径≥0.53mm的毛细管柱称为大口径毛细管柱,由于其内径比一般毛细管粗,柱的样品容量为填充柱的1/10~1/20,介于填充柱和常规毛细管柱之间,柱内载气流速可高达10~20mL/min,因此只需将气化室的内衬管和柱接头稍加改进,就可采用填充柱的进样口直接进样。
图中a、b、c、d为4种装有改进内衬管的大口径毛细管柱气化室的结构示意图。其中仅(a)具有隔垫吹扫功能。图 (a)为最常用的衬管,适合柱流速快的大多数分析,但当进样量大时,因内衬管容积小,样品气化后体积膨胀,瞬间气化室压力可能超过载气柱前压,会发生倒灌,而使样品蒸气反扩散至载气管路中。为了防止倒灌可使用图 (b),它为具有大容积的衬管,其上部为锥形,可防止样品倒灌,下部的锥形可保证样品快速进入毛细管柱。图 (c)的衬管为对(a)的改进。图(d)是为向毛细管柱内直接进样而设计的,色谱柱头一直伸到内衬管的上部,样品可直接进入柱头气化。
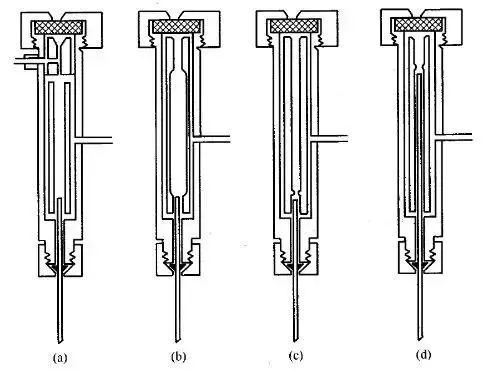
大口径毛细管柱直接进样用衬管
02
二分流进样
它是毛细管气相色谱首选的进样方式,注入样品后大部分样品被放空,仅有约1/100的样品进入毛细管柱,分流比可在1/20~1/200的范围调节。适用于大部分气体或液体样品的分析,尤其对未知样品使用分流进样,可保护毛细管柱不被沾污,防止柱效降低。
分流进样方式,由总流量阀控制载气的总流量,载气进入气化室分成两路,一路作为隔垫吹扫气,流量仅为1~3mL/min。另一路进入气化室与气化的样品蒸气混合后再分为两部分,其中大部分经分流口放空,仅小部分进入毛细管柱。若载气总流量为104mL/min,隔垫吹扫气设置为3mL/min,则101mL/min进入气化室,当分流流量为100mL/min时,柱内流量仅为1 mL/min,此时分流比为1/100。应看到此气路设计将柱前压调节阀安装在分流气路上,在载气总流量不变的情况下,提高柱前压,使柱流速增大,可加快分析速度;若保持柱前压不变,通过调节总流量阀可改变分流比,即总流量愈大,分流比也愈大。
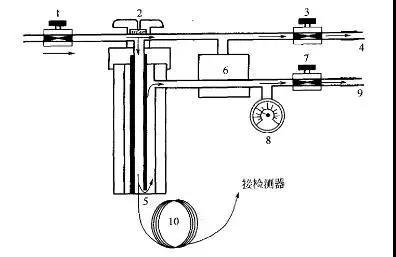
Agilent7890仪器分流进样口原理示意图
1-总流量控制阀;2-进样口;3-隔垫吹扫气调节阀;4-隔垫吹扫气出口;5-分流器;6-分流(不分流)电磁阀;7-柱前压调节阀;8-柱前压力表;9-分流出口;10-色谱柱
分流进样时,气化室的内衬管如图所示,其大部分都不是直通式,管内有缩径处或装有烧结板,在缩口处放置有玻璃珠或硅烷化玻璃毛,以增大与样品接触的面积,保证样品完全气化。填充物应位于衬管的中间温度最高处,也是注射器针尖所达到处,可减少分流歧视。
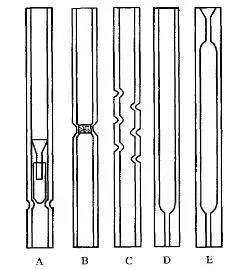
气化室的内衬管
分流歧视是指在一定分流比的条件下,由于样品中不同组分的沸点差异,而造成它们的实际分流比是不同的,因而会造成进入毛细管柱的样品组成不同于原始样品的组成,从而影响定量分析的准确度。消除分流歧视的方法是在柱容量允许的条件下,依据样品浓度尽量采用小的分流比,并尽量使样品快速气化。
03
三不分流进样
当分流进样不能满足对分析灵敏度的要求,或分析含有大量溶剂的样品中痕量组分时,才使用不分流进样技术。
为消除溶剂效应可采用瞬间不分流技术,即当进样开始时关闭分流电磁阀,使系统处于不分流状态,如图所示,此时进入系统的载气,仅为进入毛细管柱和隔垫清扫所需的载气量(3~5mL/min),然后向气化室注入2~3uL样品,经30~80s,待大部分气化样品开始进入毛细管柱,立即开启分流电磁阀,使系统处于分流状态。此时存留在气化室的大部分溶剂气体(显然也包括约5%的样品组分)很快从分流口放空,从而明显地消除了溶剂拖尾,使分流状态一直保持到分析结束,就可将原来被掩盖在溶剂拖尾峰中的组分分离出来。

Agilent7890仪器不分流进样口原理示意图
1-总流量控制阀;2-进样口;3-隔垫吹扫气调节阀;4-隔垫吹扫气出口;5-分流器;6-分流(不分流)电磁阀;7-柱前压调节阀;8-柱前压力表;9-分流出口;10-色谱柱
F,G-用于不分流进样或程序升温气化进样的气化室的内衬管
由上述可知不分流进样不是绝对不分流,而是一种将瞬间不分流与大部分时间分流相组合的进样方式。为获得准确的分析结果,如何确定瞬间不分流的时间间隔,就成为操作的关键。依据大多数文献报道,此时间间隔多采用0.75min,就能保证95%的样品进入色谱柱。此时间间隔也可自行测定,方法为:首先设置一个长的时间间隔,如120s,以保证全部样品组分都进入色谱柱,分析后从谱图上找到紧挨拖尾溶剂峰后的一个被完全分离的色谱峰作测定标志,测出该峰的峰面积值,它就代表100%的样品进入了色谱柱。然后逐步缩短不分流时间间隔,如100s、80s、60s、40s,分别进样分析,再计算标志色谱峰的峰面积与第一次分析时的峰面积比值,直到此值达到≥0.95,即为瞬间不分流的最佳时间间隔,如图所示。
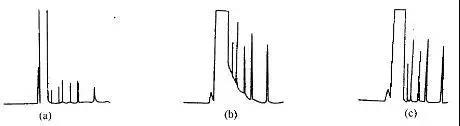
分流/不分流电磁阀开启时间的影响
(a)放空阀开启太早,只有少量样品进入柱内;
(b)放空阀开启太晚,最后样品被大大稀释,溶剂峰严重拖尾;
(c)放空阀开启时间恰到好处
一般地讲,使用高沸点溶剂比低沸点溶剂有利,因为溶剂沸点高时,容易实现溶剂聚焦,且可使用较高的色谱柱初始温度,还可降低注射器针尖歧视以及气化室的压力突变。表1中列出了常见的溶剂及其沸点和实现溶剂聚焦宜采用的色谱柱初始温度。
表1 常见溶剂的沸点和实现溶剂聚焦宜采用的色谱柱初始温度

注:①只能用于固定液交联的色谱柱。
对高沸点样品,不分流时间间隔长一些有利于提高分析灵敏度,而不影响测定准确度;对低沸点样品,则尽可能采用短的不分流时间间隔,以便既能最大限度消除溶剂拖尾,又可保证分析的准确度。
使用不分流进样时,样品进入毛细管柱的绝对量比分流进样多,并利用了溶剂效应(又称溶剂聚焦),使与溶剂挥发性相接近的微量组分被浓缩在尚未挥发的溶剂中,从而获得微量组分的狭窄谱带并提高了分离度,还可提高检测的灵敏度和定量测定结果的准确度。
应当指出,溶剂效应的正确应用会受到气化室温度,毛细管柱柱箱温度,进样量和样品中溶剂沸点的制约,它是在气化室温度、柱箱温度皆低于溶剂沸点20~25℃的条件下产生的。当气化后溶剂样品混合物大量进入色谱柱头时,大量低沸点的溶剂会在柱入口内壁短期凝聚一层越来越厚的溶剂液膜(df),起临时固定液的作用,因而会造成毛细管柱的相比β值大幅下降,但溶质的分配系数Kp保持恒定,因此会随溶剂液膜df的加厚,使样品中所有组分的容量因子k大大增加
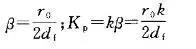
式中,r0为柱内径。
这样使进样后的样品组分的谱带前沿,总是在一个越来越厚的混合固定液液膜上移动,而样品谱带的后部则是在一个相对较薄的液膜(主要是固定液的液膜)上移动,结果使样品谱带的前沿移动得慢,而谱带后部移动得快,从而使每个组分的谱带被压缩而变窄,呈现出溶剂聚焦的效应。
另一方面,溶剂的极性一定要与样品的极性相匹配,且要保证溶剂在所有被测样品组分之前出峰,否则早流出的峰就会被溶剂的大峰掩盖。同时,溶剂还要与固定相匹配,才能实现有效的溶剂聚焦。不分流进样也是分析高沸点痕量组分的首选方法。
当采用不分流进样方式时,气化室温度设置可比分流进样时稍低一些,以使样品在气化室滞留时间长一些,气化速度稍慢一些。但此温度下限应能保证待测组分在瞬间不分流时间间隔内能完全气化。进样后应尽量采用程序升温方式操作,以保证溶剂聚焦的良好结果。进样量不宜超过2~3uL,应采用容积大的内衬管,否则会产生样品倒灌;进样速度应快些,进样速度的重现性会影响分析结果的重复性。
(来源:互联网整理)


